编者按:2024年4月14日至17日,第50届欧洲血液和骨髓移植学会(EBMT)年会在英国格拉斯哥隆重举行。会议聚焦干细胞移植和细胞疗法的最新进展,推动着血液病及血液肿瘤患者向着更好的临床预后迈进。在本届大会上,北京大学第三医院/北京高博医院克晓燕教授、北京高博医院胡凯教授团队共有两项研究被大会收录进行壁报交流,研究揭示了自体造血干细胞移植联合CAR-T细胞治疗可改善淋巴瘤和多发性骨髓瘤患者生存。

研究一
自体造血干细胞移植联合CAR-T细胞治疗可显著提高复发难治性中枢神经系统淋巴瘤的无进展生存率
汇报人:刘蕊
研究背景
复发/难治性中枢神经系统淋巴瘤(R/R CNSL)治疗在临床上具有挑战性。CAR-T疗法已被证明对复发/难治性大B细胞淋巴瘤有效,且有研究表明R/R CNSL的治疗缓解率较高。然而,无病生存期和长期疗效并不理想。本研究旨在探索CAR-T在R/R CNSL中的疗效以及影响其长期生存的因素。此外,本研究还分析了自体造血干细胞移植(ASCT)联合CAR-T疗法的安全性和有效性。
研究方法
这项单中心回顾性研究分析了2019年3月至2023年8月期间在北京高博博仁医院接受CAR-T治疗的R/R CNSL患者,基线特征见表1。68%(47/69)为脑实质受累,17%(12/69)为中枢神经系统(CNS)受累,14%(10/69)为两者兼有。65.2%(45/69)的患者经桥接治疗获得客观缓解,其中33例为完全缓解(CR),12例为部分缓解(PR)。根据桥接治疗的反应,患者被分为两组:桥接有效组(BE),包括CR/PR患者;桥接无效组(BI),包括疾病稳定(SD)/疾病进展(PD)患者。在BE组中,53.3%(24/45)的患者接受了ASCT联合CAR-T疗法。

表1.患者基线特征
研究结果
3个月的客观缓解率(ORR)为70%(48/69),完全缓解率(CRR)为61%(42/69)。任何级别细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)的发生率分别为70%(48/69)和12%(8/69),严重(≥3级)CRS和ICANS的发生率分别为12.5%(6/48)和62.5%(5/8)。与BI组相比,BE组的3个月ORR(84.4% vs. 41.6%)和CRR(82.2% vs. 20.8%)明显更高。
中位随访时间为22.65个月。BE组的中位无进展生存期(PFS)为43.07个月,显著长于BI组的6.08个月(P<0.0001)。BE组中位总生存期(OS)尚未达到,而BI组为12.79个月(P<0.0001,图1)。BE组和BI组的1年OS率分别为100%和51.4%(P<0.0001),1年PFS率分别为74.7%和9.9%(P<0.0001)。

图1. 桥接治疗有效组和无效组的OS和PFS
在45例BE组患者中,ASCT联合CAR-T治疗队列ECOG PS评分≥2分的患者较多,既往治疗线较多,且均为HD-MTX耐药(表2)。与仅CAR-T队列相比,ASCT联合CAR-T队列患者的中位PFS明显延长(未达到 vs. 14.76个月,P=0.0008)。该队列中位OS尚未达到,仅CAR-T队列的中位OS为27.48个月。然而,两个队列之间的差异无统计学意义(图2)。两个队列的CRS和ICANS亦均无统计学差异。
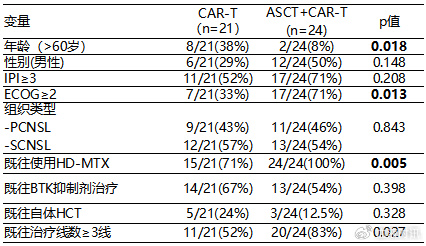
表2. 桥接治疗后有效组不同治疗队列患者的基线特征

图2. 有效组不同治疗队列的OS和PFS
研究结论
有效的桥接治疗可以显著提高CAR-T治疗R/R CNSL的疗效。桥接治疗有效后,ASCT联合CAR-T的治疗模式可显著改善无病生存。
研究二
供者人源化CAR-T细胞作为预处理方案的异基因造血干细胞移植治疗既往CAR-T疗法失败的难治/复发性B细胞淋巴瘤和多发性骨髓瘤
汇报人:杨帆
研究背景
自体嵌合抗原受体-T(CAR-T)细胞疗法失败的难治/复发性侵袭性B细胞淋巴瘤(R/R B-NHL)和多发性骨髓瘤(R/R MM)预后极差。
研究目的
本研究旨在评估采用来自同一供者的人源化CAR-T细胞(allo-CAR-T)作为预处理方案的异基因造血干细胞移植(allo-HSCT)治疗既往CAR-T细胞疗法失败的R/R B-NHL和R/R MM的疗效和安全性。
研究方法
从2020年9月到2023年11月,共入组18例患者。中位年龄为41(26-64)岁。诊断包括弥漫性大B细胞淋巴瘤(非特指型)(DLBCL-NOS)(5例)、高级别B细胞淋巴瘤(6例)、伯基特淋巴瘤(3例)和多发性骨髓瘤(4例)。11例患者携带TP53突变。疾病状态为4例患者疾病进展(PD),7例部分缓解(PR),7例完全缓解(CR),这些患者均接受过多线治疗,包括自体造血干细胞移植(ASCT,7例)、局部照射(7例)和抗PD-1单抗治疗(5例)。试验前,经病理检查确认R/R B-NHL患者CD19和CD22抗原表达阳性,R/R MM患者BCMA抗原表达阳性。匹配的同胞全相合供者4例,匹配的非亲缘供者1例,半相合供者13例。采用以白消安、氟达拉滨为基础的方案联合异基因CAR-T(allo-CAR-T)作为预处理方案。钙调蛋白抑制剂、霉酚酸酯、短期甲氨蝶呤和/或抗胸腺细胞球蛋白用于预防移植物抗宿主病(GVHD)。
研究结果
输注的中位allo-CAR-T细胞数为2(范围:0.2-4.88)×106/kg。16例患者出现细胞因子释放综合征(CRS),其中4例为Ⅲ级,未发生免疫效应细胞相关神经毒性综合征(ICANS)。粒细胞集落刺激因子动员的外周造血干细胞在allo-CAR-T后7天输注,中位CD34+细胞数为6(范围:3-8.19)×106/kg。所有病例的中位中性粒细胞和血小板植入时间分别为移植后15天(范围:11-24天)和16天(范围:13-65天)。移植后28天骨髓STR分析显示18例(100%)均为供者型。2例患者发生III级急性GVHD。CAR-T细胞在体内扩增达到峰值的中位时间为CAR-T细胞输注后5天(范围:1-20天)。PCR检测的CAR-T细胞中位峰值水平为50.81%(范围:0.091-116)。aGVHD与体内异基因CAR-T细胞扩增不直接相关。7/18(38.9%)例患者在造血干细胞移植后的2个月内CAR-T细胞水平很低,且持续了5个月,迄今最长持续时间为移植后239天。中位随访时间为8.9个月(0.69-133.8个月)时,17例(17/18,94.4%)达到CR,最长缓解持续时间(DoR)达34.5个月。6例患者缓解后疾病复发,4例(4/6,66.6%)复发后接受供者allo-CAR-T细胞治疗,且其中3例(3/4,75%)再次达到CR。
2年无进展生存(PFS)率和总生存(OS)率分别为30.2%(95%CI:9.5-54.3)OS和40.4%(95%CI:14.7-65.2)。相比之下,移植前PR/CR队列的PFS和OS明显长于PD队列,两个队列的中位PFS为10.2个月 vs. 1.9个月(P=0.0006),中位OS为14.8个月 vs. 6.5个月(P=0.0178)。4例(4/18,22.2%)移植前疾病状态为PD的患者死于疾病进展,4例患者(4/18,22.2%)死于感染。所有患者的生存泳道图见图1。

图1. 所有患者的生存泳道图
研究结论
对于CAR-T细胞疗法失败的R/R B-NHL和MM患者,使用allo-CAR-T细胞作为预处理方案的allo-HSCT是一种安全有效的策略。CRS可控,对造血重建没有影响。急性GVHD和病毒再激活轻微。临床疗效不佳者与其移植前肿瘤负荷较高有关。